Contesto e progettazione dello studio
Retatrutide (LY3437943) è un nuovo farmaco monopeptide che attivatre recettori contemporaneamente: GIP, GLP-1 e glucagone. Per valutarne l'efficacia e la sicurezza in soggetti obesi ma senza diabete, è stato condotto uno studio di fase 2, randomizzato, in doppio cieco, controllato con placebo (NCT04881760). Un totale di338 partecipanticon un BMI ≥30, o ≥27 con almeno una comorbidità correlata al peso, sono stati randomizzati a ricevere placebo o retatrutide (1 mg, 4 mg con due schemi di titolazione, 8 mg con due schemi di titolazione o 12 mg) somministrati una volta alla settimana tramite iniezione sottocutanea per 48 settimane.endpoint primarioera la variazione percentuale del peso corporeo a 24 settimane, con endpoint secondari che includevano la variazione del peso a 48 settimane e soglie di perdita di peso categoriali (≥5%, ≥10%, ≥15%).
Risultati chiave
-
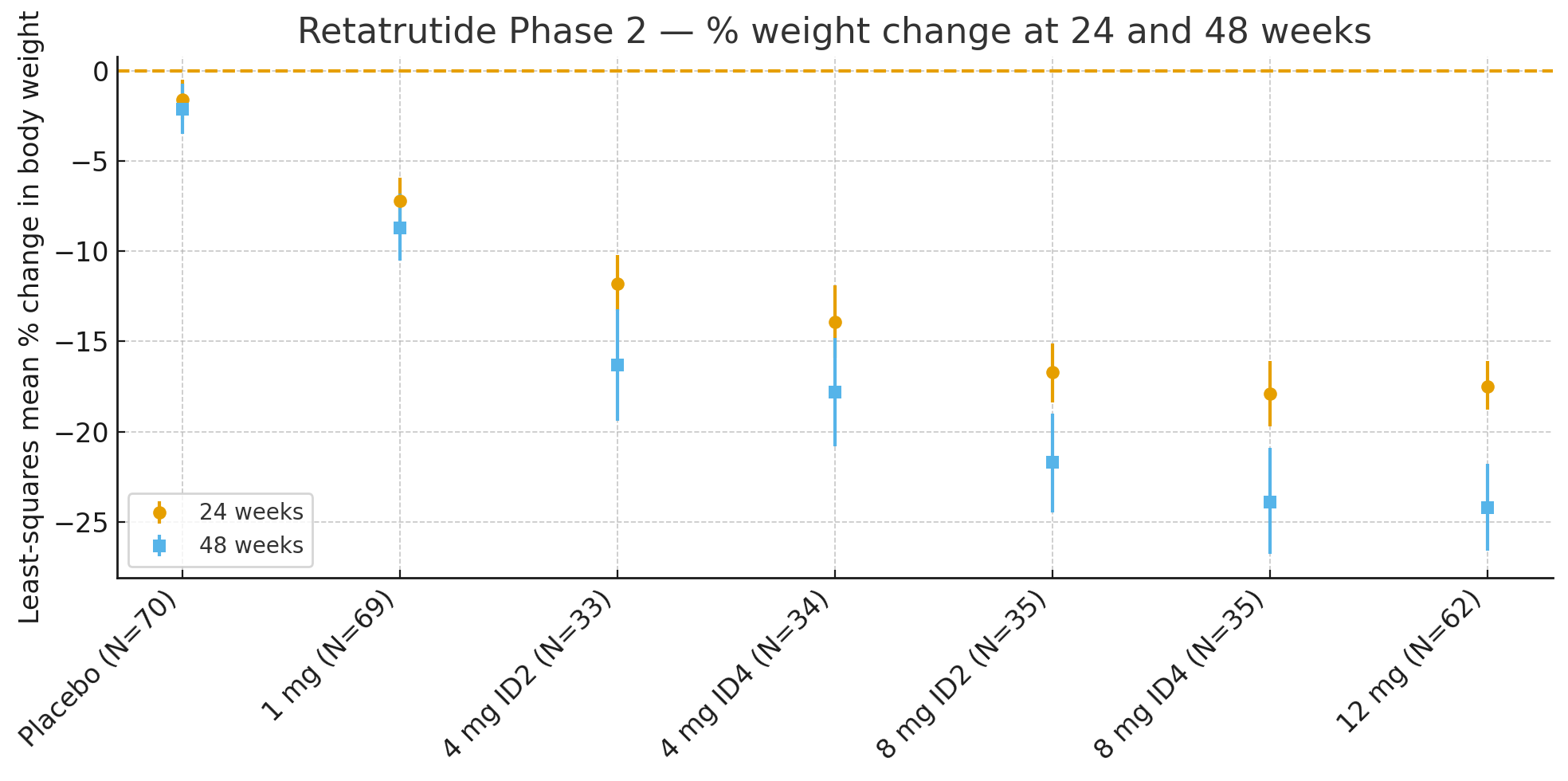
24 settimane: La variazione percentuale media dei minimi quadrati del peso corporeo rispetto al basale è stata
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (combinati): −12,9%
-
8 mg (combinati): −17,3%
-
12 mg: −17,5%
-
-
48 settimane: La variazione percentuale del peso corporeo è stata
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (combinati): −17,1%
-
8 mg (combinati): −22,8%
-
12 mg: −24,2%
-
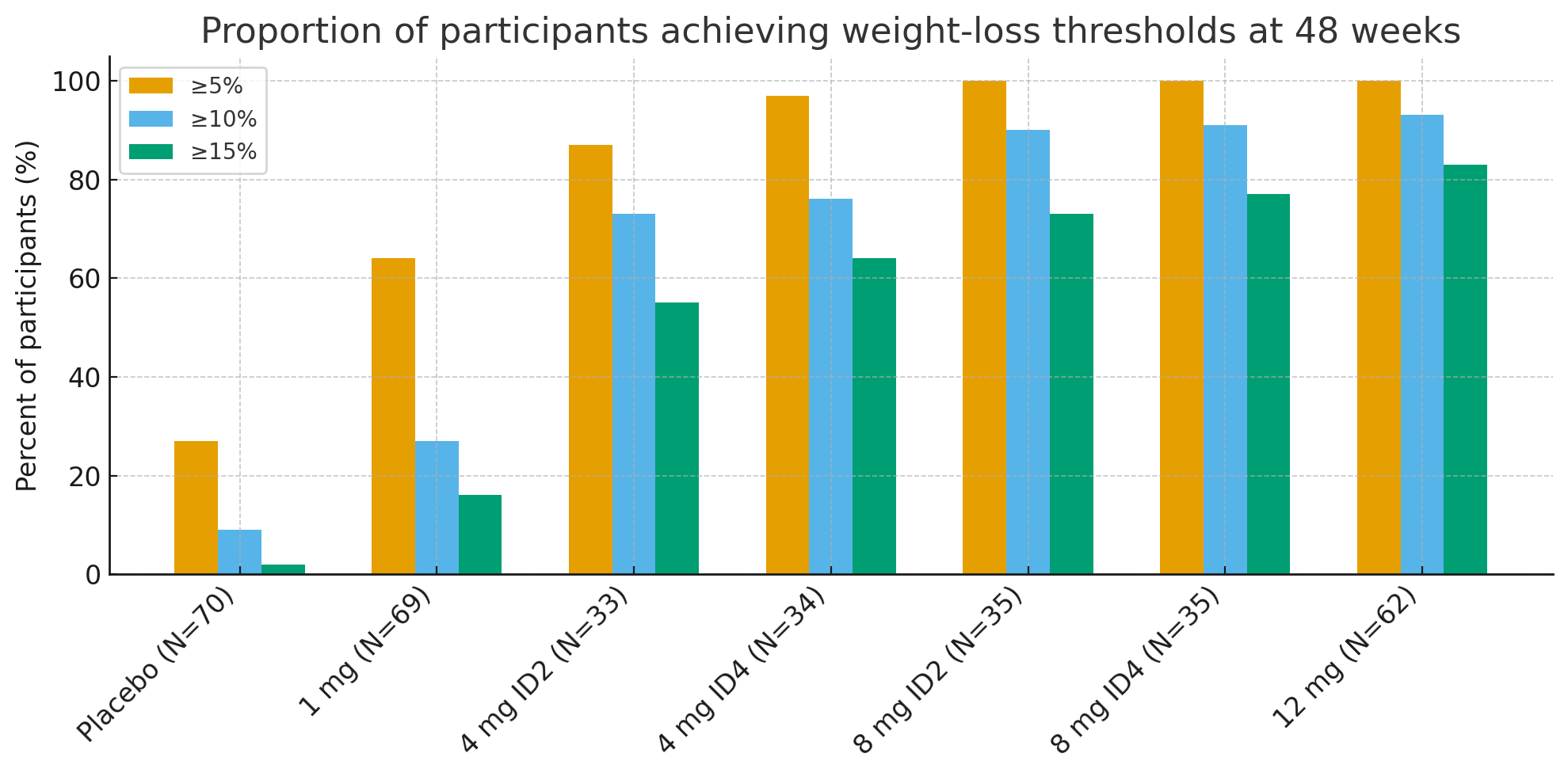
A 48 settimane, le percentuali di partecipanti che hanno raggiunto soglie di perdita di peso clinicamente significative sono state sorprendenti:
-
Perdita di peso ≥5%: 27% con placebo vs. 92-100% nei gruppi attivi
-
≥10%: 9% con placebo vs. 73-93% nei gruppi attivi
-
≥15%: 2% con placebo vs. 55-83% nei gruppi attivi
Nel gruppo da 12 mg, fino aIl 26% dei partecipanti ha perso ≥30% del loro peso basale, un'entità di perdita di peso paragonabile alla chirurgia bariatrica.
Sicurezza
Gli eventi avversi più comuni sono stati di tipo gastrointestinale (nausea, vomito, diarrea), generalmente da lievi a moderati e dose-correlati. Dosi iniziali più basse (titolazione di 2 mg) hanno ridotto questi eventi. Sono stati osservati aumenti della frequenza cardiaca dose-correlati, con picco alla settimana 24, per poi diminuire. I tassi di interruzione sono variati dal 6 al 16% nei gruppi trattati con farmaco attivo, leggermente superiori rispetto al placebo.
Conclusioni
Negli adulti con obesità senza diabete, la somministrazione sottocutanea settimanale di retatrutide per 48 settimane ha prodottoriduzioni sostanziali e dose-dipendenti del peso corporeo(fino a circa il 24% di perdita media alla dose più elevata), insieme a miglioramenti nei marcatori cardiometabolici. Gli eventi avversi gastrointestinali sono stati frequenti ma gestibili con la titolazione. Questi risultati di fase 2 suggeriscono che retatrutide potrebbe rappresentare un nuovo punto di riferimento terapeutico per l'obesità, in attesa di conferma in studi di fase 3 più ampi e a lungo termine.
Data di pubblicazione: 28 settembre 2025