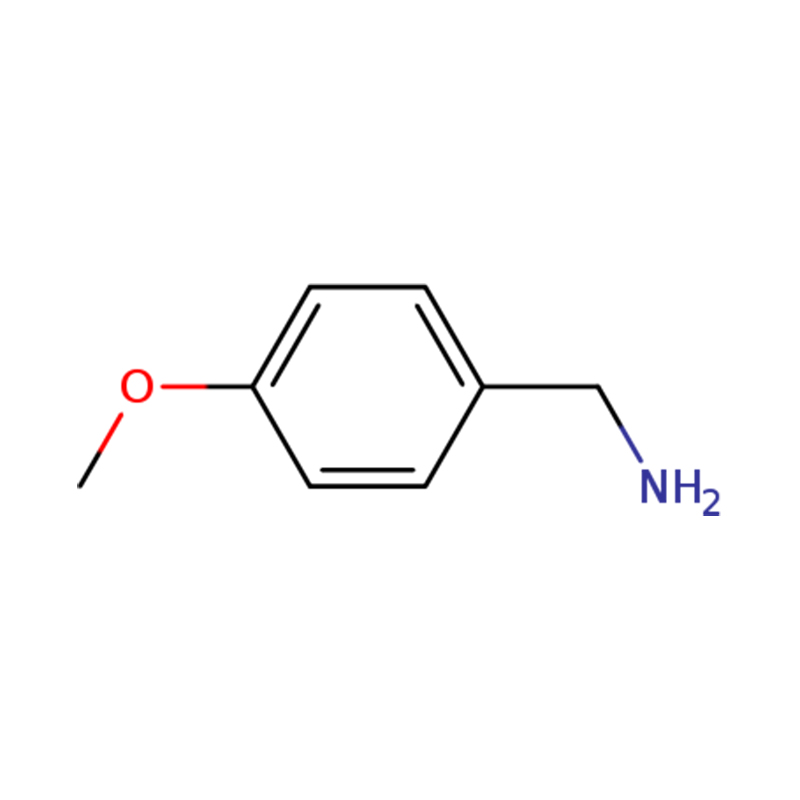
1-(4-METOSSIFENIL)METANAMMINA
Dettagli del prodotto
| Numero di telefono | 2393-23-9 | Tempi di consegna | entro 10 giorni |
| Molecolare | C8H11NO | Capacità produttiva | 1 tonnellata metrica/giorno |
| Aspetto | Liquido limpido, incolore o leggermente giallo | Purezza | 99% minimo |
| Applicazione | Intermedi farmaceutici | Magazzinaggio | Temperatura ambiente, buio, sigillato |
| LimitNum | 1 chilogrammo | Trasporti | Aereo, marittimo, espresso. |
| Densità | 1,05 g/mLat25°C(lit.) | Punto di ebollizione | 236-237°C(lit.) |
| Punto di fusione | -10°C | Indice di rifrazione | n20/D1.546(lett.) |
| Punto d'infiammabilità: | >230°F | Solubilità | Altamente solubile in acqua |
| Nome | p-anisilammina o (4-metossifenil)metanamina |
sinonimi
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETHYL-ANISOLE; 4-METOSSIBENZILAMINA; P-Metossibenzilammina cloridrato 173,64; 4-Metossibenzilammina, 98+%; per sparfloxacina; P-METOSSIBENZILAMINA CLORIDRATO
Applicazione
Può essere utilizzato per la sintesi di intermedi farmaceutici. È leggermente nocivo per l'acqua. Evitare il contatto di prodotti non diluiti o in grandi quantità con falde acquifere, corsi d'acqua o sistemi fognari. Senza autorizzazione governativa, non scaricare materiali nell'ambiente circostante per evitare il contatto con ossidi, acidi, aria e anidride carbonica. Tenere il contenitore sigillato, inserirlo in un estrattore ermetico e conservarlo in un luogo fresco e asciutto.
Laboratorio di controllo qualità
All'interno del sito è presente un laboratorio di controllo qualità individuale, dove vengono eseguiti test chimici, fisici, microbiologici, studi di stabilità e test strumentali come IR, UV, HPLC e GC su materie prime e prodotti finiti. L'intera area è ad accesso controllato e ben tenuta, dotata di una strumentazione analitica adeguata per le analisi previste. Tutti gli strumenti sono ben etichettati e opportunamente calibrati.
QA
Il QA è responsabile della valutazione e della categorizzazione delle deviazioni in livello Maggiore, livello Generale e livello Minore. Per tutti i livelli di deviazione, è necessaria un'indagine per identificare la causa principale o potenziale. L'indagine deve essere completata entro 7 giorni lavorativi. Una volta completata l'indagine e identificata la causa principale, sono richiesti anche la valutazione dell'impatto sul prodotto e il piano CAPA. La deviazione viene chiusa con l'implementazione del CAPA. Tutte le deviazioni devono essere approvate dal Responsabile QA. Dopo l'implementazione, l'efficacia del CAPA viene confermata in base al piano.